Учёные разработали новые противоопухолевые соединения
Учёные разработали новые противоопухолевые соединения.jpg

Трижды негативный рак молочной железы (ТНРМЖ) характеризуется агрессивной формой и высокими показателями заболеваемости и смертности. Главная особенность этого вида опухолей – отсутствие на поверхности раковых клеток специфических рецепторов: гормональных – прогестероновых и эстрогеновых, а также рецепторов эпидермального фактора роста 2-го типа (он присутствует в тканях и участвует в регуляции деления и дифференцировки клеток). Рецепторы отвечают за развитие и функционирование раковых клеток, и воздействие на них различными противоопухолевыми препаратами позволяет подавить активность клеток и тем самым остановить рост опухоли.
– Как правило, прогнозы по таким опухолям плохие. Таргетная терапия практически невозможна, потому что важные рецепторы отсутствуют, – поясняет директор центра медицинской химии Тольяттинского госуниверситета (ТГУ) Александр Бунев. – Здесь вроде бы должна сработать классическая химиотерапия, но она воздействует не только на раковые, но и на клетки кроветворения, то есть, это лечение с массой побочных эффектов. Кроме того, после энного количества курсов классической химиотерапии у этой трижды негативной опухоли начинает появляться устойчивость к такому лечению, и оно становится неэффективным, а дальнейший рост опухоли – более агрессивным.
Примерно 15-20% случаев выявляемого рака молочной железы относятся к трижды негативному типу, и чаще всего такой диагноз ставится женщинам моложе 40 лет. Поэтому усилия специалистов в науке и медицине сосредоточены на выявлении новых методов лечения.
Работают над проблемой и участники консорциума «Медицинская химия», инициированного Тольяттинским госуниверситетом в 2021 году в рамках федеральной программы «Приоритет 2030». Поиск новых соединений, способных убивать опухолевые клетки, ведётся в рамках проекта OpenHTS (Open High-Throughput Screening – открытая платформа для высокопроизводительного скрининга). Для этого в ТГУ создан один из самых крупных в России банк опухолевых клеток.
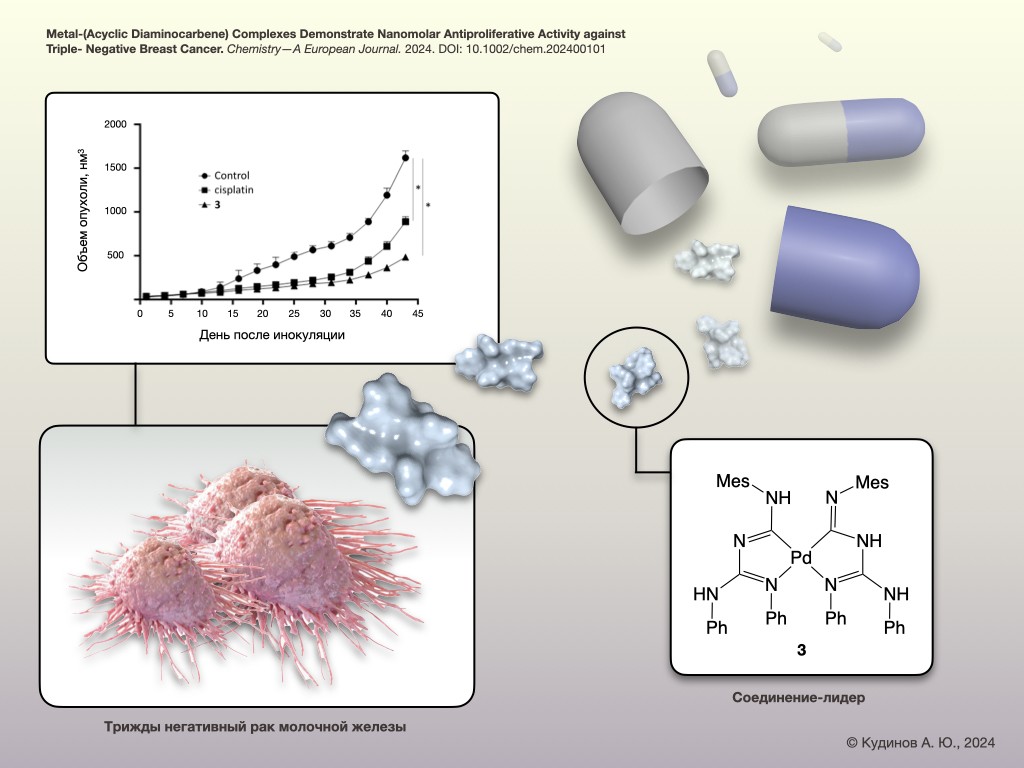
Недавно партию новых веществ синтезировали исследователи Санкт-Петербургского государственного университета (СПбГУ) в содружестве со специалистами Белорусского государственного университета (БГУ). Группа доцента, доктора химических наук Михаила Кинжалова из института химии СПбГУ уже не первый год ведёт разработку обладающих потенциальными противоопухолевыми свойствами комплексных соединений на основе платины и палладия.
– На основе этих соединений можно создавать структуры уникальной пространственной сложности, что позволяет более точно взаимодействовать с биологическими мишенями. Однако химические связи металл-лиганд, как правило, имеют низкую энергетику, что делает органические производные переходных металлов склонными к быстрому разрушению в организме. Наша работа сосредоточена на преодолении этого ограничения путём продуманного дизайна молекул. В результате, синтезированные соединения обладают высокой стабильностью и могут сохранять свои свойства неизменными в течение длительного времени, – говорит Михаил Кинжалов.
Серию полученных недавно веществ учёные СПбГУ передали на тестирование в центр медицинской химии Тольяттинского госуниверситета. Для скрининга исследователи ЦМХ ТГУ использовали панель клеточных линий, которая среди прочих содержала клетки рака молочной железы двух типов: классический рак, который чувствителен к гормонам, и лабораторная модель трижды негативного рака. Также исследования велись на здоровых клетках – первичных фибробластах (из них состоит кожа) и эмбриональных клетках человеческой почки.
– Когда мы получили и протестировали эти вещества, то обнаружили соединение (хит), которое, во-первых, «работает» на модели одного из самых сложных клинических случаев рака молочной железы – ТНРМЖ. Во-вторых, оказалось, что оно в три раза менее токсично для эмбриональных клеток почки человека и примерно в 350 раз менее токсично для фибробластов, – рассказывает Александр Бунев. – То есть, наш хит – не просто агент, который убивает всё на своём пути. Он обладает селективностью.
Ещё одним весомым плюсом стала активность соединения в наномолярном диапазоне, то есть в очень низких концентрациях.
– Если в клеточных тестах получается добиться активности хита при такой концентрации, то это вещество можно «впихнуть» в таблетку. И значит, имеет смысл дополнять исследования доклиническими испытаниями, чтобы попробовать достичь терапевтических концентраций, то есть, концентраций, приводящих к полноценному противоопухолевому эффекту, – говорит Александр Бунев. – Но на людях такие испытания на ранних этапах проводить недопустимо, поэтому используют in vivo модель ксенографта.
Ксенографт – экспериментальная опухолевая модель, в которой человеческая опухоль прививается лабораторным мышам. Такой эксперимент осуществили в лаборатории биомаркеров и механизмов опухолевого ангиогенеза НМИЦ онкологии им. Н.Н. Блохина. Опухоль, привитую мышам, обрабатывали новым соединением, а также для сравнения используемым в химиотерапии онкологических заболеваний препаратом платины цисплатином.
– Эксперимент с ростом образцов трижды негативного рака молочной железы человека на мышах длился в течение 45 дней, – рассказал заведующий лабораторией Дмитрий Хоченков. – При длительной обработке цисплатином опухоль привыкла к химиотерапии и спустя время снова начала расти. При этом новое соединение продемонстрировало статистически значимое ингибирование (подавление) роста ксенотранспланатата ТНРМЖ на мышах по сравнению с препаратом сравнения. Это подтверждает эффективность вещества на живых организмах и представляет интерес для его дальнейшей разработки в качестве противоопухолевого лекарственного средства.
Результаты этой масштабной исследовательской работы специалисты СПбГУ, БГУ, ТГУ и НМИЦ имени Н.Н. Блохина описали в статье, которую опубликовал Chemistry: A European Journal (Q2, IF 5.020). Еженедельный международный рецензируемый научный журнал на своих страницах размещает широкий спектр материалов исследований авторов со всего мира из самых разных областей химии и смежных областей.
1216
просмотров